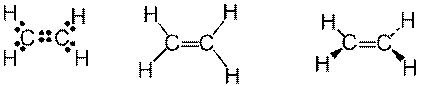
Eteenissä hiiliatomit voivat olla neliarvoisia vain, jos C-C sidosta on muodostamassa neljä sidoselektronia. Tällöin kysymyksessä on kaksoissidos C=C.

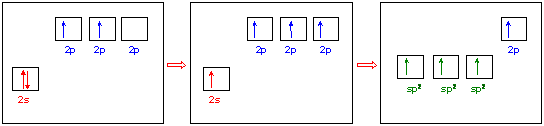
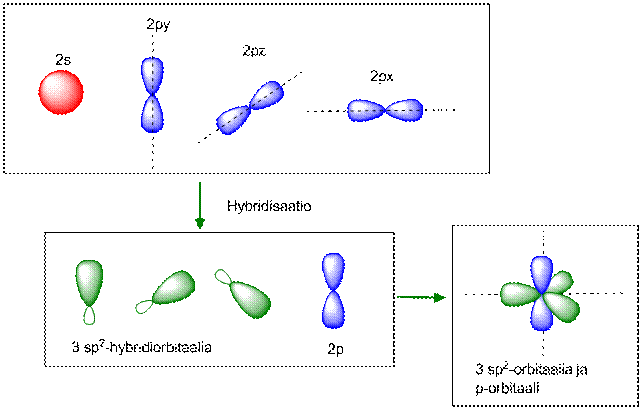
Kaksoissidoksen syntyessä yksi s-orbitaali ja kaksi p-orbitaalia hybridisoituu kolmeksi sp2-hybridiorbitaaliksi. Yksi p-orbitaali jää muuntumatta.
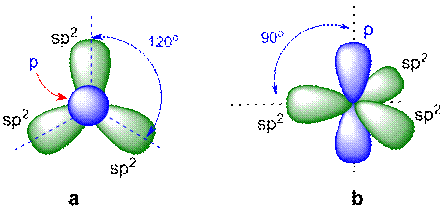
sp3- ja p-orbitaalit (a) ylhäältä ja (b) sivulta kuvattuna.
Kaksoissidoksen muodostuessa hiiliatomit sitoutuvat toisiinsa ensin hybridiorbitaalien muodostamalla s-sidoksella. Hiiliatomi muodostaa kaksi s-sidosta muiden atomien kanssa siten, että sidosten välinen kulma on 120° ja sidokset ovat samassa tasossa, joten kaksoissidoksen kohdalta molekyyli on tasomainen. Muuntumattomat 2p-elektronit muodostavat s-sidoksen rinnalle pii(p)-sidoksen. p-Sidoksen elektronitiheys on pienempi kuin s-sidoksen, jolloin se on s-sidosta heikompi ja reagoi helposti.
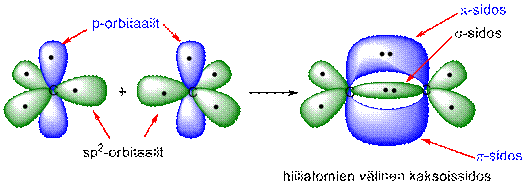
Kaksoissidosta sanotaan tyydyttymättömäksi sidokseksi. p-Sidos estää molekyylin kiertymisen akselinsa ympäri ja aiheuttaa sidokselle jäykän rakenteen.
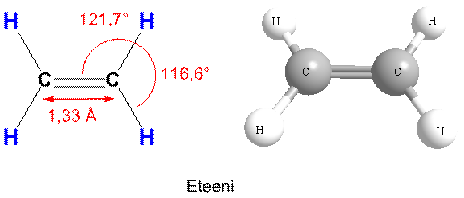
Eteenin C=C sidoksen pituus, 1,33 Å, on lyhempi kuin etaanilla (1.54 Å) ja sidoslujuus, 152 kcal/mol, suurempi kuin etaanilla (88 kcal/mol).
Tehtävä. Formaldehydi, CH2O, sisältää C=O kaksoissidoksen. Piirrä sen Lewis- ja viivasidosrakenne ja osoita hiili- ja happiatomien hybridisaatio sekä sidoskulmat. Vastaus
| Sisällysluettelo | 1. Johdanto: orgaanisten yhdisteiden rakenne ja sidokset; hapot ja emäkset |